A termodinamika az energia és annak átalakulásainak tudománya, amely a fizika és a kémia számos területén alapvető fontosságú. Ennek a tudományágnak az egyik legfontosabb, mégis gyakran félreértett fogalma a belső energia. Bár a mindennapi nyelvben ritkán találkozunk vele, a mérnöki, kémiai és fizikai folyamatok megértéséhez elengedhetetlen. Cikkünkben mélyebben belemerülünk az „abszolút belső energia” fogalmába, megvizsgáljuk jelentőségét a termodinamikában, és feltárjuk a mögötte rejlő komplexitást.
Amikor egy rendszer energiájáról beszélünk, hajlamosak vagyunk olyan külső formákra gondolni, mint a mozgási vagy helyzeti energia. A belső energia azonban egy sokkal mélyebb, a rendszer belső állapotából fakadó energiaforma. Ez a molekulák, atomok és az azokat alkotó részecskék mikroszkopikus mozgásával és kölcsönhatásaival kapcsolatos energia. Képzeljünk el egy pohár vizet. Makroszkopikus szinten nyugalomban van, nincs mozgási energiája a környezethez képest, és a földfelszínhez viszonyítva a helyzeti energiája is állandó. Mikroszkopikus szinten azonban a vízmolekulák folyamatosan mozognak: rezegnek, forognak, egymáshoz képest elmozdulnak. Emellett az atomokon belüli elektronok is rendelkeznek energiával, és a kémiai kötésekben is tárolódik energia. Mindezek az energiák együttesen alkotják a rendszer belső energiáját.
A belső energia tehát egy összetett mennyiség, amely magában foglalja a rendszerben lévő összes mikroszkopikus energiaformát. Ide tartozik a molekulák és atomok transzlációs (helyváltoztató), rotációs (forgó) és vibrációs (rezgő) mozgásából eredő kinetikus energia, valamint az atomok közötti, illetve a molekulákon belüli kölcsönhatásokból származó potenciális energia. Ezen felül a kémiai kötésekben tárolt energia, az elektronok energiája, sőt, rendkívül magas energiájú folyamatok esetén még az atommagokban rejlő energia is hozzájárul a belső energiához. A belső energia jelölése általában U, és mértékegysége a Joule (J) a Nemzetközi Mértékegységrendszerben.
A belső energia alapszintű megértése: Mi is az valójában?
A belső energia, mint termodinamikai állapotfüggvény, egy rendszer állapotát jellemzi. Nem a rendszer külső mozgásával vagy helyzetével kapcsolatos, hanem kizárólag a rendszer belső, mikroszkopikus szintű alkotóelemeinek energiáival függ össze. Ez az energia a rendszer atomjainak és molekuláinak kaotikus, rendezetlen mozgásából és az ezek közötti kölcsönhatásokból adódik. Képzeljünk el egy gázt egy zárt tartályban. A gázmolekulák állandóan ütköznek egymással és a tartály falával. Ezek az ütközések és a molekulák mozgása képezik a gáz belső energiájának jelentős részét.
A belső energia tehát egyfajta „rejtett” energia, amely a rendszer hőmérsékletét, nyomását, térfogatát és kémiai összetételét meghatározó mikroszintű folyamatokban nyilvánul meg. Fontos megérteni, hogy a belső energia nem azonos a hővel. A hő a belső energia átadásának egyik módja, míg a belső energia maga a rendszerben tárolt energia. Hasonlóképpen, a munka is egy energiaátadási forma, amely a belső energia változását eredményezheti.
Egy rendszer belső energiája a makroszkopikus paraméterek, például a hőmérséklet, nyomás és térfogat segítségével írható le, de a valódi értékét a mikroszkopikus szinten zajló folyamatok adják. Minél magasabb egy anyag hőmérséklete, annál nagyobb az atomok és molekulák átlagos kinetikus energiája, és így annál nagyobb a rendszer belső energiája is. Ez azonban nem csak a mozgási energiára korlátozódik. A molekulák közötti vonzó és taszító erők, valamint a kémiai kötésekben tárolt energia is hozzájárul a teljes belső energia értékéhez.
Miért „abszolút” a belső energia, és miért relatív a klasszikus termodinamikában?
Az „abszolút belső energia” kifejezés hallatán könnyen azt gondolhatjuk, hogy létezik egy univerzális, nullához viszonyított érték, amelyet bármely rendszerre pontosan meg lehet határozni. A klasszikus termodinamika keretein belül azonban ez a megközelítés problematikus. A klasszikus termodinamika nem foglalkozik a mikroszkopikus részecskék egyedi energiáival, hanem a makroszkopikus tulajdonságok, mint a hőmérséklet, nyomás és térfogat közötti kapcsolatokat vizsgálja. Ezen a szinten a belső energia abszolút értékének meghatározása rendkívül nehéz, sőt, bizonyos értelemben értelmetlen.
Ennek oka, hogy a belső energia magában foglalja az atommagok energiáját, az elektronok energiáját és a kémiai kötések energiáját is, amelyeknek a pontos nullpontját nehéz, vagy szinte lehetetlen definiálni. Gondoljunk például a kémiai potenciális energiára: hogyan definiálnánk egy atom abszolút kémiai energiáját, ha az nem vesz részt semmilyen kötésben? A termodinamikai számításokhoz elegendő a belső energia változását (ΔU) meghatározni, ami szerencsére könnyebben mérhető és értelmezhető. Ez hasonló ahhoz, mint amikor a potenciális energiát számítjuk: egy tárgy potenciális energiája a földfelszínhez képest nulla, de egy másik referenciaponthoz képest (pl. egy asztalhoz képest) már más értéket vehet fel. Az abszolút potenciális energia fogalma is viszonylagos.
A klasszikus termodinamika tehát a relatív belső energiaváltozásokra fókuszál. Amikor egy rendszer energiát vesz fel vagy ad le a környezetével (hő vagy munka formájában), a belső energiája megváltozik. Ez a változás az, ami a legfontosabb a folyamatok leírásában és a mérnöki számításokban. Az „abszolút” kifejezés inkább a statisztikus mechanika és a kvantummechanika területén nyer értelmet, ahol a részecskék egyedi energiaszintjeit és a nullponti energiát is figyelembe veszik. Ezen elméletek szerint elvileg lehetséges egy abszolút nullponthoz viszonyított belső energia meghatározása, de a gyakorlatban, a legtöbb termodinamikai alkalmazásban, a változásokra koncentrálunk.
„A klasszikus termodinamika nem a belső energia abszolút értékét, hanem annak változásait vizsgálja, mivel ezek a változások közvetlenül megfigyelhetők és mérhetők a rendszer és környezete közötti energiaátadás révén.”
A belső energia mint állapotfüggvény és extenzív tulajdonság
A termodinamikában a belső energia (U) egy alapvető állapotfüggvény. Ez azt jelenti, hogy az értéke kizárólag a rendszer aktuális termodinamikai állapotától függ, függetlenül attól, hogyan jutott el abba az állapotba. Például, ha egy gáz egy adott hőmérsékletre, nyomásra és térfogatra jut, a belső energiája mindig ugyanaz lesz, függetlenül attól, hogy izoterm, izobár vagy adiabatikus folyamat során érte el ezt az állapotot. Ez a tulajdonság élesen megkülönbözteti az olyan mennyiségektől, mint a hő (Q) és a munka (W), amelyek útfüggő mennyiségek. A hő és a munka értéke attól függ, milyen úton halad a rendszer egyik állapotból a másikba.
Az állapotfüggvények jelentősége abban rejlik, hogy lehetővé teszik a termodinamikai folyamatok egyszerűsített leírását. Ha ismerjük egy rendszer kezdeti és végállapotát, azonnal meghatározhatjuk a belső energia változását anélkül, hogy figyelembe vennénk a folyamat részleteit. Ez rendkívül hasznos a kémiai reakciókban, ahol a reakcióhő meghatározásához elegendő a reagensek és a termékek belső energiájának különbségét ismerni.
A belső energia emellett extenzív tulajdonság is. Ez azt jelenti, hogy az értéke arányos a rendszer méretével vagy az anyagmennyiségével. Ha például megduplázzuk egy adott hőmérsékletű és nyomású gáz mennyiségét, a belső energiája is megduplázódik. Ezzel szemben az intenzív tulajdonságok, mint a hőmérséklet, nyomás vagy sűrűség, függetlenek a rendszer méretétől. Egy pohár víz és egy tó vize ugyanazon hőmérsékletű lehet, de a tó vizének belső energiája sokkal nagyobb lesz a nagyobb anyagmennyiség miatt. Az extenzív tulajdonságokat gyakran moláris mennyiségekké alakítják (pl. moláris belső energia, J/mol), hogy intenzív tulajdonságot kapjanak, ami összehasonlíthatóvá teszi a különböző rendszereket.
A termodinamika első főtétele és a belső energia kapcsolata
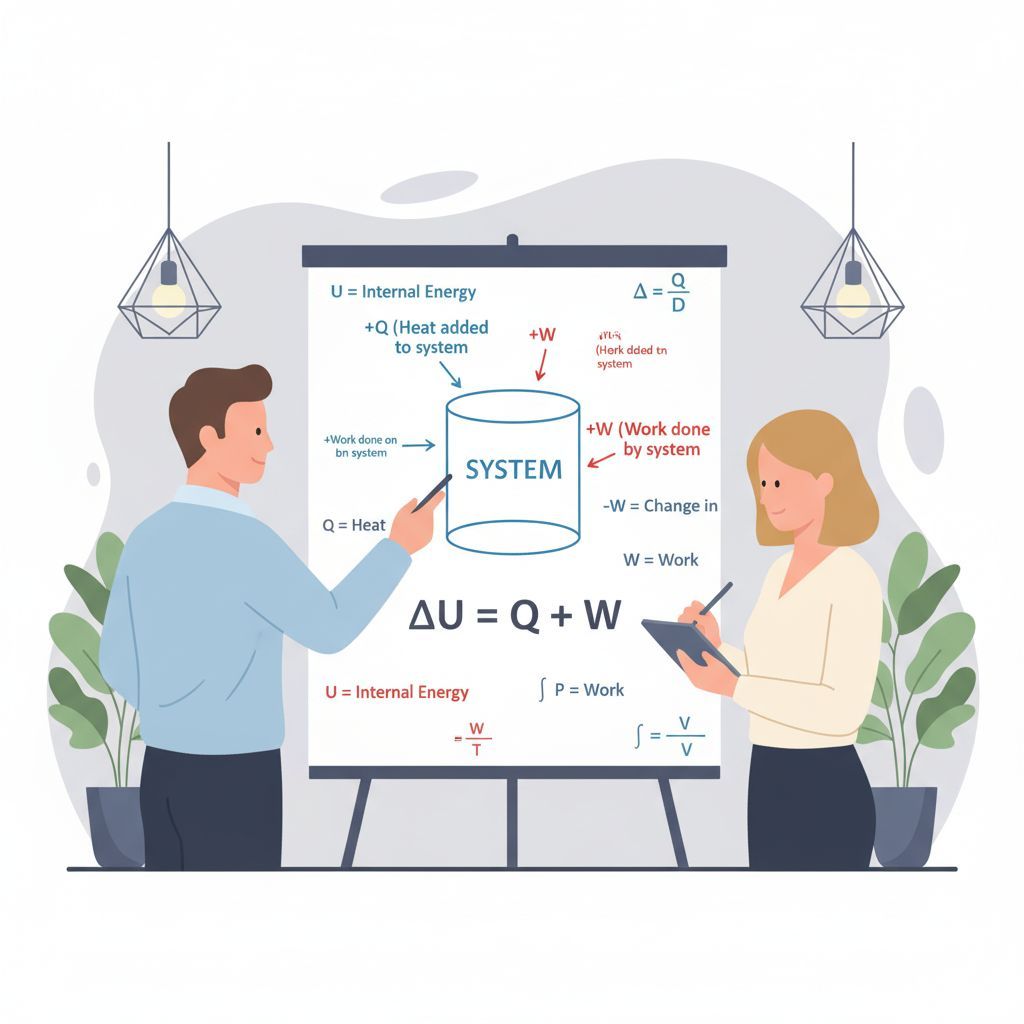
A termodinamika első főtétele az energia megmaradásának elvét fejezi ki, alkalmazva azt termodinamikai rendszerekre. Ez az egyik legfontosabb alapelv a fizikában és a kémiában, és közvetlenül kapcsolódik a belső energia fogalmához. A főtétel kimondja, hogy egy zárt rendszer belső energiájának változása (ΔU) egyenlő a rendszerrel közölt hő (Q) és a rendszeren végzett munka (W) összegével. Matematikailag ez így fejezhető ki:
ΔU = Q + W
Ez az egyenlet azt jelenti, hogy a rendszer belső energiája csak kétféle módon változhat: hőcsere vagy munkavégzés útján. Ha a rendszer hőt vesz fel a környezetétől (Q > 0), vagy ha a környezet munkát végez a rendszeren (W > 0, ez a legtöbb fizikai konvenció szerint), akkor a rendszer belső energiája növekszik. Fordítva, ha a rendszer hőt ad le (Q < 0), vagy ha a rendszer munkát végez a környezeten (W < 0), akkor a belső energiája csökken.
Az első főtétel alapvető üzenete, hogy az energia nem hozható létre és nem pusztítható el, csak átalakulhat egyik formából a másikba. Ez azt is jelenti, hogy nem létezik olyan gép, amely a semmiből hozna létre energiát (elsőfajú örökmozgó). Minden energiaátalakítás során a teljes energia mennyisége állandó marad, csak a formája változik. A belső energia a rendszerben tárolt energia, amely a hő és a munka révén képes kölcsönhatásba lépni a környezettel.
„A termodinamika első főtétele a belső energia változásán keresztül manifesztálja az energia megmaradásának egyetemes elvét, hangsúlyozva, hogy a rendszer energiája csak hőátadás vagy munkavégzés útján módosulhat.”
A hő és a munka szerepe a belső energia változásában
A hő és a munka a két fő mechanizmus, amelyen keresztül egy termodinamikai rendszer energiát cserélhet a környezetével, és ezáltal megváltoztathatja belső energiáját. Fontos különbséget tenni a kettő között, mivel bár mindkettő energiaátadás, a mögöttes fizikai folyamatok eltérőek.
A hő (Q) az energia átadása a rendszer és a környezete között hőmérséklet-különbség hatására. Ez egy rendezetlen energiaátadás, amely a mikroszkopikus részecskék (atomok, molekulák) kinetikus energiájának átadásával történik. Ha a rendszer melegebb, mint a környezete, hőt ad le; ha hidegebb, hőt vesz fel. A hőátadás történhet vezetéssel, konvekcióval vagy sugárzással. Például, amikor egy edényt a tűzhelyre teszünk, a lángból származó hő a vízbe áramlik, növelve annak belső energiáját és hőmérsékletét.
A munka (W) az energia átadása rendezett mozgás révén. A termodinamikában leggyakrabban a térfogati munkával találkozunk, amelyet egy gáz végez, amikor tágul vagy összenyomódik egy külső nyomás ellenében. Ha egy gáz tágul és tol egy dugattyút, munkát végez a környezeten (W < 0). Ha a környezet nyomást gyakorol a gázra és összenyomja azt, a környezet végez munkát a gázon (W > 0). A munka más formákban is megjelenhet, például elektromos munka (akkumulátor töltése/kisütése), felületi feszültség által végzett munka, vagy mágneses munka. A lényeg, hogy a munka során az energiaátadás valamilyen makroszkopikus, rendezett erőhatással és elmozdulással jár.
A hő és a munka tehát különböző módokon befolyásolják a belső energiát, de a végeredményt tekintve mindkettő képes a rendszer energiatartalmát módosítani az első főtételnek megfelelően. Egy zárt rendszer esetében az összes energiaváltozás a hő és a munka összegéből adódik.
A hőmérséklet és a fázisállapot hatása a belső energiára
A belső energia szoros kapcsolatban áll a rendszer hőmérsékletével és fázisállapotával. Ezek a paraméterek alapvetően befolyásolják a részecskék mozgását és kölcsönhatásait, így közvetlenül hatnak a belső energiára.
A hőmérséklet emelkedése általában a belső energia növekedését vonja maga után. Ez azért van, mert a hőmérséklet definíció szerint a részecskék átlagos kinetikus energiájának mértéke. Ahogy a hőmérséklet nő, a molekulák gyorsabban mozognak, intenzívebben rezegnek és forognak, ami növeli a rendszer kinetikus energia komponensét. Gázok esetében ez a hatás különösen hangsúlyos, mivel ott a potenciális energia hozzájárulása viszonylag csekély. Folyadékok és szilárd anyagok esetében is igaz ez, de ott a részecskék közötti kölcsönhatásokból adódó potenciális energia is jelentősebb szerepet játszik.
A fázisállapot változása, mint például az olvadás, forrás vagy szublimáció, szintén drámai módon befolyásolja a belső energiát. Ezek a folyamatok ún. látens hőt (rejtett hőt) igényelnek vagy szabadítanak fel anélkül, hogy a hőmérséklet változna. Például, amikor a jég olvad vízzé 0 °C-on, energiát vesz fel a környezetéből (olvadáshő), de a hőmérséklete nem változik. Ez a felvett energia nem a molekulák kinetikus energiáját növeli, hanem a potenciális energiájukat: a vízmolekulák közötti kötések gyengülnek, és nagyobb szabadságot nyernek a mozgásban. Hasonlóképpen, a víz forrása során (párolgáshő) a folyékony állapotból gáz halmazállapotba való átmenet során a molekulák teljesen elszakadnak egymástól, ami jelentős potenciális energia növekedést jelent.
Összefoglalva, a hőmérséklet elsősorban a molekulák kinetikus energiáját befolyásolja, míg a fázisállapot változása a molekulák közötti potenciális energiát módosítja. Mindkettő alapvető tényező a rendszer teljes belső energiájának meghatározásában.
A kémiai összetétel és a belső energia
A belső energia nem csupán a hőmérséklettől és a fázisállapottól függ, hanem a rendszer kémiai összetételétől is. A kémiai kötésekben tárolt energia, az atomok elrendeződése a molekulákban, valamint az elektronok energiaszintjei mind hozzájárulnak a rendszer teljes belső energiájához. Ez különösen nyilvánvaló a kémiai reakciók során, ahol az anyagok kémiai átalakuláson mennek keresztül.
Amikor egy kémiai reakció lejátszódik, a reagensek atomjai átrendeződnek, új kötések jönnek létre, és régiek szakadnak fel. Minden kémiai kötésben egy bizonyos mennyiségű energia tárolódik. Egy kötés felszakításához energiát kell befektetni (endoterm folyamat), míg egy kötés létrejötte energiát szabadít fel (exoterm folyamat). A reakció során a termékek belső energiája általában különbözik a reagensek belső energiájától.
A kémiai reakciók során bekövetkező belső energiaváltozást, állandó térfogaton mérve, reakcióhőnek is nevezzük. Ha a reakció során energia szabadul fel (exoterm), a rendszer belső energiája csökken, és ez az energia hő formájában távozik a környezetbe. Ilyen például az égés, amikor az üzemanyagban tárolt kémiai energia hővé alakul. Ha a reakció energiát igényel (endoterm), a rendszer belső energiája növekszik, és hőt von el a környezetéből, ami hűtő hatást eredményezhet.
A kémiai összetétel és a belső energia közötti kapcsolat alapvető a kémiai termodinamika számára, lehetővé téve a reakciók spontaneitásának és egyensúlyi állapotának előrejelzését. Az üzemanyagok, robbanóanyagok, gyógyszerek és szinte minden anyag energia-tulajdonságai a kémiai belső energiájukból fakadnak.
Ideális gázok belső energiája: Egyszerűsített modell

Az ideális gáz fogalma egy egyszerűsített modell, amelyet a termodinamika gyakran használ a gázok viselkedésének leírására. Bár egyetlen valós gáz sem tökéletesen ideális, ez a modell rendkívül hasznos a termodinamikai alapelvek megértéséhez és a komplexebb rendszerek kiindulópontjaként. Az ideális gáz modellje a következő alapfeltevéseken alapul:
- A gáz részecskéi pontszerűek, azaz elhanyagolható a saját térfogatuk a tartály térfogatához képest.
- A gáz részecskéi között nincsenek vonzó vagy taszító erők (nincs potenciális energia a kölcsönhatásokból).
- A részecskék közötti és a tartály falával való ütközések tökéletesen rugalmasak.
Ezen feltevések alapján az ideális gáz belső energiája kizárólag a részecskék kinetikus energiájából adódik, és így csak a hőmérséklettől függ. A nyomás és a térfogat változása, állandó hőmérsékleten, nem befolyásolja az ideális gáz belső energiáját. Ezt a jelenséget Joule törvényének is nevezik. Az ideális gázok belső energiája a következő összefüggéssel írható le:
U = n * Cv * T
ahol U a belső energia, n az anyagmennyiség (mólban), Cv az állandó térfogaton mért moláris hőkapacitás, T pedig az abszolút hőmérséklet (Kelvinben). A Cv értéke függ a gáz molekuláris szerkezetétől (pl. egyatomos, kétatomos vagy többatomos gáz).
Ez az egyszerűsítés rendkívül hasznos, mert lehetővé teszi a termodinamikai folyamatok analitikus kezelését. Például, ha egy ideális gáz izoterm (állandó hőmérsékletű) táguláson megy keresztül, a belső energiája nem változik (ΔU = 0). Ekkor az első főtétel szerint Q = -W, azaz a rendszer által végzett munka pontosan megegyezik a környezetből felvett hővel.
Reális anyagok belső energiája: Komplexitás és kölcsönhatások
Míg az ideális gáz modellje hasznos kiindulópont, a reális anyagok belső energiája sokkal komplexebb. A valóságban a részecskék nem pontszerűek, és jelentős kölcsönhatásban állnak egymással, különösen folyadék és szilárd állapotban. Ezek a kölcsönhatások, mint például a Van der Waals erők, hidrogénkötések vagy fémes kötések, jelentős mértékben hozzájárulnak a rendszer potenciális energiájához, és így a teljes belső energiához is.
Reális gázok esetében a molekulák közötti vonzó erők csökkentik a rendszer belső energiáját, mivel a molekulák közelebb kerülnek egymáshoz, és stabilabb állapotba kerülnek. Ezenkívül a molekulák saját térfogata sem elhanyagolható, ami befolyásolja a mozgásteret és az ütközések dinamikáját. Ezek a tényezők a nyomás és a térfogat függvényévé teszik a belső energiát, nem csak a hőmérséklet függvényévé, mint az ideális gázoknál.
Folyadékok és szilárd anyagok esetében a molekulák közötti kölcsönhatások még erősebbek, és a potenciális energia hozzájárulása a belső energiához dominánssá válik. Egy szilárd anyagban az atomok szigorú rácsban helyezkednek el, és csak rezegni tudnak a rácspontok körül. A rezgési energiájuk adja a kinetikus energiát, míg a rácsban lévő atomok közötti kötések jelentik a potenciális energiát. Folyadékokban a molekulák már elmozdulhatnak egymáshoz képest, de még mindig erős kölcsönhatásban állnak. Emiatt a folyadékok és szilárd anyagok belső energiájának pontos leírásához komplexebb állapotegyenletekre és modellekre van szükség, amelyek figyelembe veszik az intermolekuláris erőket, a molekulák méretét és a rendszert alkotó részecskék szerkezeti elrendeződését.
Belső energia és entalpia: Kapcsolat és különbségek
A termodinamikában számos állapotfüggvény létezik, amelyek a rendszerek energiaállapotát írják le. A belső energia (U) mellett az entalpia (H) az egyik leggyakrabban használt fogalom, különösen a kémiai termodinamikában és a mérnöki gyakorlatban. Bár szorosan kapcsolódnak, fontos megérteni a különbséget közöttük.
Az entalpia a belső energia és a rendszer nyomás-térfogat szorzatának összegeként definiálható:
H = U + pV
ahol H az entalpia, U a belső energia, p a nyomás és V a térfogat. Az entalpia is állapotfüggvény és extenzív tulajdonság.
Miért van szükség az entalpiára, ha már van belső energia? A válasz a kísérleti körülményekben rejlik. Sok kémiai és fizikai folyamat, különösen a laboratóriumi körülmények között, állandó nyomáson megy végbe (pl. egy nyitott edényben, atmoszférikus nyomáson). Ilyen esetekben a rendszer és a környezet közötti hőcsere (Qp) egyenlő az entalpia változásával (ΔH). Az állandó nyomáson mért hőcsere tehát közvetlenül az entalpiaváltozást adja meg, ami sokkal kényelmesebb a mérések szempontjából, mint a belső energia változásának (ΔU) meghatározása, amely állandó térfogatú folyamatokra vonatkozik (Qv).
Az entalpia tehát egy olyan állapotfüggvény, amelyet azért vezettek be, hogy az állandó nyomású folyamatok termodinamikai elemzése egyszerűbbé váljon. Míg a belső energia a rendszerben tárolt teljes energiát képviseli, az entalpia magában foglalja azt az energiát is, amely a rendszer térfogatának fenntartásához szükséges a külső nyomás ellenében. Gyakorlatilag, ha állandó térfogaton vizsgálunk egy folyamatot (pl. bombakaloriméterben), a ΔU a releváns. Ha állandó nyomáson (pl. nyitott főzőpohárban), akkor a ΔH.
A belső energia és az entrópia: Mikroszkopikus nézőpont
Míg a belső energia (U) a rendszerben tárolt energia mennyiségét írja le, az entrópia (S) egy másik alapvető termodinamikai állapotfüggvény, amely a rendszer rendezetlenségének vagy valószínűségének mértékét jelzi. Bár eltérő fogalmak, a statisztikus mechanika révén szoros kapcsolatban állnak egymással, és mindkettő elengedhetetlen a rendszerek termodinamikai viselkedésének teljes megértéséhez.
Az entrópia a termodinamika második főtételének kulcsfogalma, amely kimondja, hogy az izolált rendszerek entrópiája spontán folyamatok során mindig növekszik, vagy a reverzibilis folyamatok során állandó marad. Makroszkopikus szinten ez a rendezetlenség növekedését jelenti. Mikroszkopikus szinten az entrópia a rendszer lehetséges mikroállapotainak számával kapcsolatos, amelyek egy adott makroállapotot (pl. adott hőmérséklet, nyomás) eredményeznek. Minél több mikroállapot felel meg egy makroállapotnak, annál nagyobb az entrópia.
A belső energia és az entrópia kapcsolata a statisztikus mechanikában válik igazán világossá. A statisztikus mechanika a makroszkopikus termodinamikai tulajdonságokat a rendszer mikroszkopikus alkotóelemeinek (atomok, molekulák) viselkedéséből vezeti le. Az energiaeloszlás (azaz hogy a részecskék hogyan oszlanak el az elérhető energiaszinteken) közvetlenül befolyásolja mind a belső energiát, mind az entrópiát. Egy magasabb belső energiájú rendszerben általában több energiaszint áll a részecskék rendelkezésére, és több módon oszthatók el ezeken a szinteken, ami nagyobb entrópiát eredményez.
Az entrópia és a belső energia közötti kapcsolat a termodinamika alapvető egyenletében is megjelenik:
dU = TdS – pdV
Ez az egyenlet azt mutatja, hogy a belső energia változása hogyan kapcsolódik a hőmérséklethez (T), az entrópia változásához (dS) és a nyomás-térfogat munkához (pdV). Az TdS tag a hő formájában átadott energia reverzibilis folyamatokban, és rávilágít az entrópia szerepére az energiaátalakításokban.
Szabadenergia-függvények és a belső energia
A belső energia és az entalpia mellett a termodinamika két másik kulcsfontosságú állapotfüggvényt is használ a folyamatok spontaneitásának és egyensúlyának leírására: a Helmholtz szabadenergiát (A) és a Gibbs szabadenergiát (G). Ezek a szabadenergia-függvények a belső energiából (vagy entalpiából) és az entrópiából származnak, és rendkívül fontosak a kémiai reakciók és a fázisátalakulások megértésében.
A Helmholtz szabadenergia (A) a következőképpen definiálható:
A = U – TS
ahol U a belső energia, T az abszolút hőmérséklet, S pedig az entrópia. A Helmholtz szabadenergia különösen hasznos az állandó hőmérsékletű és állandó térfogatú (izoterm-izochor) folyamatok vizsgálatakor. Egy ilyen rendszerben a spontán folyamatok a Helmholtz szabadenergia csökkenésének irányába haladnak, és az egyensúlyi állapotot akkor éri el a rendszer, amikor A minimális. A dA ≤ 0 feltétel azt jelenti, hogy a rendszer a környezetével nem cserélhet hőt vagy munkát, de a belső energiája csökkenhet a spontán folyamatok során.
A Gibbs szabadenergia (G) pedig a következőképpen definiálható:
G = H – TS
vagy a definíciós egyenletből kiindulva: G = U + pV – TS. Itt H az entalpia. A Gibbs szabadenergia a leggyakrabban használt szabadenergia a kémiában és a biokémiában, mivel a legtöbb kémiai reakció állandó hőmérsékleten és állandó nyomáson (izoterm-izobár) megy végbe. Egy ilyen rendszerben a spontán folyamatok a Gibbs szabadenergia csökkenésének irányába haladnak, és az egyensúlyi állapotot akkor éri el a rendszer, amikor G minimális (dG ≤ 0). A Gibbs szabadenergia változása megadja azt a maximális hasznos munkát, amelyet egy rendszer végezhet állandó hőmérsékleten és nyomáson.
Mindkét szabadenergia-függvény megmutatja, hogy a rendszer belső energiájának mekkora része alakítható át hasznos munkává, figyelembe véve a rendszer entrópiáját és a hőmérsékletet. Ezek a fogalmak kulcsfontosságúak a kémiai reakciók termodinamikai elemzésében, az egyensúlyi állandók meghatározásában és a fázisdiagramok értelmezésében.
A belső energia statisztikus mechanikai megközelítése: Mikroállapotok és valószínűség
Míg a klasszikus termodinamika makroszkopikus szinten írja le a belső energiát, a statisztikus mechanika hidat épít a mikroszkopikus részecskék viselkedése és a makroszkopikus termodinamikai tulajdonságok között. Ez a megközelítés lehetővé teszi a belső energia mélyebb, atomi szintű megértését, és rávilágít arra, hogyan kapcsolódik az energiaeloszlás a rendszer termodinamikai állapotához.
A statisztikus mechanikában egy rendszer makroszkopikus állapotát (pl. adott hőmérséklet, nyomás, térfogat) rengeteg különböző mikroállapot valósíthatja meg. Egy mikroállapot a rendszer összes részecskéjének pontos, egyedi kvantummechanikai állapotát (pozícióját és impulzusát) írja le. A belső energia a rendszer összes lehetséges mikroállapotának súlyozott átlaga, ahol a súlyozást az egyes mikroállapotok valószínűsége adja.
A kulcsfontosságú eszköz a statisztikus mechanikában a Boltzmann-eloszlás, amely megadja az egyes energiaszintek betöltöttségének valószínűségét egy adott hőmérsékleten. Minél magasabb az energiaszint, annál kisebb a valószínűsége annak, hogy egy részecske azt a szintet foglalja el, de ez a valószínűség a hőmérséklet emelkedésével nő. A rendszer teljes belső energiája (U) az egyes energiaszintek energiájának és a megfelelő energiaszinten tartózkodó részecskék számának szorzatainak összegeként számítható ki.
Egy másik alapvető fogalom a partíciófüggvény (Z), amely magában foglalja a rendszer összes lehetséges energiaszintjét és azok Boltzmann-tényezőit. A partíciófüggvényből származtatható a rendszer összes termodinamikai tulajdonsága, beleértve a belső energiát is. A belső energia a partíciófüggvény hőmérséklet szerinti deriválásával kapható meg, ami egy rendkívül elegáns és erőteljes kapcsolatot teremt a mikroszkopikus és makroszkopikus világ között.
Ez a megközelítés nemcsak elméleti betekintést nyújt, hanem lehetővé teszi a komplex anyagok termodinamikai tulajdonságainak előrejelzését is molekuláris szintű paraméterekből, ami különösen fontos az anyagtudományban és a nanotechnológiában.
A kvantummechanika szerepe az abszolút belső energia értelmezésében
A klasszikus termodinamika korlátai az „abszolút” belső energia meghatározásában a kvantummechanika megjelenésével kerültek feloldásra. A kvantummechanika alapvetően megváltoztatta a részecskék energiaállapotairól alkotott képünket, és lehetővé tette, hogy értelmet adjunk az abszolút nullponthoz viszonyított energiának.
A kvantummechanika egyik legfontosabb megállapítása, hogy az energia nem folytonos, hanem kvantált, azaz csak diszkrét energiaszinteket vehet fel. Ez azt jelenti, hogy az atomok és molekulák csak bizonyos meghatározott energiamennyiségekkel rendelkezhetnek. Amikor egy rendszer energiát vesz fel vagy ad le, az kvantumugrások formájában történik az energiaszintek között.
A kvantummechanika bevezette a nullponti energia fogalmát is. A Heisenberg-féle határozatlansági elv szerint még abszolút nulla fokon sem állhatnak teljesen nyugalomban a részecskék, hanem rendelkeznek egy minimális, nem nulla energiával. Ez a nullponti energia az anyag belső energiájának abszolút alsó határa. Például egy molekula rezgési mozgása még a legalacsonyabb energiaszinten is rendelkezik nullponti energiával. Ez az energia nem vonható ki a rendszerből, és nem alakítható át munkává, de hozzájárul a rendszer teljes belső energiájához.
Ez a nullponti energia adja a lehetőséget az „abszolút” belső energia értelmezésére. Ha a referenciapontot a rendszer abszolút nulla fokon, a nullponti energiát is figyelembe véve határozzuk meg, akkor elvileg lehetséges egy abszolút érték megadása. A kémiai kötések energiája, az elektronok energiaszintjei, sőt, az atommagok energiája is kvantált, és ezek az energiák mind hozzájárulnak a rendszer abszolút belső energiájához. Bár a gyakorlatban továbbra is a belső energia változásait mérjük, a kvantummechanika elméleti alapot ad az abszolút érték létezésének és értelmezésének.
Az abszolút nulla fok és a belső energia
Az abszolút nulla fok, vagyis a 0 Kelvin (-273.15 °C), a legalacsonyabb elméletileg elérhető hőmérséklet. Ez az a pont, ahol a klasszikus fizika szerint a részecskék minden termikus mozgása megszűnik. A termodinamika harmadik főtétele kimondja, hogy egy tökéletes kristályos anyag entrópiája nullához közelít, ahogy a hőmérséklet az abszolút nulla fokhoz közelít. De mi történik ekkor a belső energiával?
A klasszikus termodinamika szerint abszolút nulla fokon a rendszer belső energiája minimális lenne, mivel megszűnik a hőmérséklettel összefüggő kinetikus energia. Azonban a kvantummechanika árnyalja ezt a képet a nullponti energia fogalmával, amelyet már említettünk. Még abszolút nulla fokon sem szűnik meg teljesen a részecskék mozgása a Heisenberg-féle határozatlansági elv miatt. Ez a minimális, kvantummechanikai eredetű energia hozzájárul az anyag belső energiájához, és ez az energia nem távolítható el a rendszerből.
Tehát abszolút nulla fokon a rendszer belső energiája nem feltétlenül nulla, hanem egy minimális, nullponti energiából és a kémiai kötésekben, valamint az atommagokban tárolt energiából áll. Ez a nullponti energia nem termikus jellegű, azaz nem kapcsolódik a hőmérséklethez, és nem alakítható át munkává hőerőgépekben. Ez a kvantummechanikai megállapítás kulcsfontosságú az abszolút belső energia elméleti értelmezésében, és rávilágít a klasszikus és kvantummechanikai termodinamika közötti különbségekre.
A gyakorlatban az abszolút nulla fokot soha nem sikerült teljesen elérni, csak rendkívül közel kerülni hozzá. A kriogén technológiák folyamatosan feszegetik a határokat, és a nagyon alacsony hőmérsékleteken végzett kutatások (pl. Bose-Einstein kondenzátumok, szupravezetés) mélyebb betekintést engednek az anyag alapvető tulajdonságaiba és a belső energia viselkedésébe ezeken az extrém körülményeken.
A belső energia változásának mérése és számítása

Ahogy korábban említettük, a klasszikus termodinamika keretein belül a belső energia abszolút értékét nehéz, ha nem lehetetlen közvetlenül mérni. Ehelyett a belső energia változását (ΔU) mérjük és számítjuk, ami a legtöbb gyakorlati alkalmazásban elegendő. Az első főtétel (ΔU = Q + W) adja az alapot ehhez, mivel a hő (Q) és a munka (W) mérhető mennyiségek.
A hőcsere (Q) mérése általában kalorimetria segítségével történik. Kaloriméterek olyan eszközök, amelyekben egy folyamat során felszabaduló vagy elnyelődő hőt mérik egy ismert hőkapacitású közeg (gyakran víz) hőmérséklet-változásának megfigyelésével. A leggyakoribb kalorimétertípusok:
- Bombakaloriméter: Ez egy állandó térfogatú készülék, amelyet általában égési reakciók hőjének mérésére használnak. Mivel a térfogat állandó, a rendszer nem végez térfogati munkát (W = 0), így a mért hőcsere (Qv) közvetlenül megegyezik a belső energia változásával (ΔU = Qv).
- Nyitott kaloriméter (pl. kávéscsésze kaloriméter): Ez állandó nyomáson működik, és a mért hőcsere (Qp) az entalpia változásával (ΔH) egyezik meg. A ΔU ebből számítható, ha ismerjük a térfogati munkát (W = -pΔV).
A munkavégzés (W) mérése függ a munka típusától. A térfogati munka (pΔV) kiszámítható a nyomás és a térfogat változásának ismeretében. Elektromos munka esetén az áramerősség és a feszültség mérésével határozható meg.
A belső energia változása emellett termodinamikai összefüggések és állapotegyenletek segítségével is számítható. Ha ismerjük az anyag hőkapacitását és az állapotfüggvények (hőmérséklet, nyomás, térfogat) változását, akkor a ΔU értéke integrálással meghatározható. Különösen ideális gázok esetében egyszerű a számítás, mivel ott a belső energia csak a hőmérséklettől függ.
Kalorimetria és a belső energia meghatározása
A kalorimetria a hőáramlások mérésének tudománya, és a belső energia (vagy entalpia) változásának meghatározásában kulcsfontosságú szerepet játszik. A kaloriméter egy olyan eszköz, amely lehetővé teszi, hogy egy rendszer által felvett vagy leadott hőt pontosan megmérjük, miközben a rendszer kémiai vagy fizikai átalakuláson megy keresztül.
A leggyakoribb kaloriméter típus, amelyet a belső energia változásának mérésére használnak, a bombakaloriméter. Ez egy robusztus, zárt, acélból készült tartály, amelyet úgy terveztek, hogy ellenálljon a magas nyomásnak. A minta (pl. egy üzemanyag) a bombában található, amelyet oxigénnel töltenek fel, majd elektromos szikrával begyújtanak. Az égési reakció során felszabaduló hő felmelegíti a bombát és az azt körülvevő vízköpenyt. A vízhőmérséklet emelkedését pontosan mérik, és mivel a bomba térfogata állandó, a rendszer nem végez térfogati munkát. Így a mért hőcsere (Qv) közvetlenül megadja a reakció belső energia változását (ΔU = Qv).
A kaloriméter hőkapacitása (Ckal) kulcsfontosságú a pontos méréshez. Ez az érték megmondja, mennyi energiát kell közölni a kaloriméterrel ahhoz, hogy a hőmérséklete 1 Kelvin fokkal emelkedjen. Ezt az értéket általában egy ismert hőfelszabadulású standard reakcióval kalibrálják. A mért hőmérséklet-változás (ΔT) és a kaloriméter hőkapacitása alapján a felszabaduló/elnyelődő hő kiszámítható: Q = -Ckal * ΔT.
A kalorimetria nem csak égési reakciókra korlátozódik. Különböző típusú kalorimétereket használnak oldódási, semlegesítési, fázisátalakulási és egyéb folyamatok hőjének mérésére. Bár a technológia fejlődésével egyre kifinomultabb módszerek állnak rendelkezésre, a kalorimetria alapelvei változatlanok maradtak, és továbbra is a belső energia és az entalpia változásának meghatározásának egyik legmegbízhatóbb módját képezik.
A belső energia jelentősége a mérnöki gyakorlatban és a technológiában
A belső energia fogalma nem csupán elméleti érdekesség, hanem alapvető jelentőséggel bír a mérnöki gyakorlatban és a modern technológiában. Számos ipari folyamat, energiaátalakítási rendszer és anyagtudományi alkalmazás megértéséhez és optimalizálásához elengedhetetlen a belső energia viselkedésének ismerete.
- Hőerőgépek és hűtőgépek: A gőzturbinák, belső égésű motorok és hűtőgépek működése szorosan kapcsolódik a termodinamika első főtételéhez és a belső energia változásaihoz. A mérnököknek pontosan tudniuk kell, hogyan alakul át az üzemanyagban tárolt kémiai belső energia hővé, majd munkává, vagy hogyan távolítható el a hő egy rendszerből a hűtés során. A hatásfok optimalizálása, a kibocsátások csökkentése és a rendszerek megbízhatóságának növelése mind a belső energia alapos megértését igényli.
- Kémiai reaktorok tervezése: A vegyipari mérnököknek figyelembe kell venniük a kémiai reakciók belső energia változásait a reaktorok méretezésekor, a hűtési/fűtési rendszerek tervezésekor és a biztonsági protokollok kidolgozásakor. Egy exoterm reakció során felszabaduló energia szabályozása elengedhetetlen a robbanások elkerüléséhez és a termékminőség biztosításához.
- Anyagtudomány és anyagmérnökség: Az anyagok belső energiája befolyásolja fizikai tulajdonságaikat, például a szilárdságukat, hővezető képességüket és fázisátalakulásaikat. Az ötvözetek tervezése, a kerámiák előállítása vagy a polimerek feldolgozása során a belső energia változásainak és az anyagszerkezetre gyakorolt hatásainak ismerete kulcsfontosságú az optimális tulajdonságú anyagok előállításához.
- Energiatárolás: Akkumulátorok, hidrogén üzemanyagcellák, hőtároló rendszerek – mindezek az eszközök a kémiai vagy fizikai belső energia tárolására és felszabadítására épülnek. A hatékony és biztonságos energiatároló megoldások fejlesztése a belső energia mélyreható ismeretét igényli.
A belső energia tehát egy univerzális fogalom, amely a mérnöki tudományok széles spektrumán keresztül biztosítja az alapokat a rendszerek tervezéséhez, elemzéséhez és optimalizálásához.
Példák a belső energia szerepére a mindennapokban
Bár a „belső energia” kifejezés tudományosnak hangzik, a mindennapi életünk számos jelensége szorosan kapcsolódik hozzá. Anélkül, hogy tudnánk róla, folyamatosan találkozunk a belső energia átalakulásaival és megnyilvánulásaival.
- Ételek emésztése: Amikor eszünk, a táplálékban tárolt kémiai belső energiát alakítjuk át szervezetünk számára felhasználható energiává. A komplex szénhidrátok, zsírok és fehérjék lebontása során kémiai reakciók mennek végbe, amelyek energiát szabadítanak fel. Ez az energia biztosítja a testünk működéséhez szükséges hőt (fenntartja a testhőmérsékletet) és munkát (izommozgás, agyi tevékenység).
- Autómotorok: Egy belső égésű motorban az üzemanyag (benzin vagy dízel) kémiai belső energiája alakul át hővé az égés során. Ez a hő megnöveli a gázok belső energiáját és nyomását, ami a dugattyúk mozgását eredményezi, azaz munkát végez. Ez a munka hajtja meg az autót.
- Fűtés és hűtés: Télen a fűtésrendszer hőt juttat a lakásba, növelve a levegő és a tárgyak belső energiáját, ezáltal emelve a hőmérsékletet. Nyáron a légkondicionáló hőt von el a lakásból, csökkentve a belső energiát és hűtve a teret. Ezek a folyamatok mind a belső energia változásain alapulnak.
- Akkumulátorok és elemek: Ezek az eszközök elektrokémiai belső energiát tárolnak. Amikor használjuk őket, kémiai reakciók mennek végbe, amelyek elektromos energiát termelnek. A töltés során pedig külső elektromos energiát alakítanak kémiai belső energiává, amit eltárolnak.
- Főzés: Amikor ételt főzünk, hőt közlünk vele, ami növeli az étel molekuláinak belső energiáját. Ez a megnövekedett energia hatására a molekulák gyorsabban mozognak, a kémiai kötések átalakulnak, és az étel textúrája, íze megváltozik.
Ezek a példák jól illusztrálják, hogy a belső energia alapvető fogalom a minket körülvevő világ megértésében és a technológiai fejlesztésekben.
Energiatárolás és a belső energia

Az energiatárolás a modern társadalom egyik legnagyobb kihívása és kulcsfontosságú területe, különösen a megújuló energiaforrások (nap, szél) ingadozó termelése miatt. A belső energia különböző formái alapvető szerepet játszanak az energiatárolási technológiákban.
- Hőtárolás: Egyes rendszerek hőt tárolnak, amelyet később felhasználhatnak fűtésre vagy energiatermelésre. Ez történhet érzékelhető hő tárolásával (az anyag hőmérsékletének emelésével növeljük a belső energiáját, pl. forró víz tartályban), vagy látens hő tárolásával (fázisváltó anyagok, mint a paraffin vagy a sóoldatok, amelyek fázisátalakulásuk során nagy mennyiségű energiát képesek felvenni vagy leadni állandó hőmérsékleten, megváltoztatva ezzel a potenciális belső energiájukat).
- Kémiai energiatárolás: Ez a legelterjedtebb forma, amely a kémiai kötésekben tárolt belső energiát használja fel.
- Akkumulátorok: Elektrokémiai reakciók során kémiai belső energiát alakítanak elektromos energiává és fordítva. A töltés során külső elektromos energia növeli a kémiai belső energiát, míg a kisütés során ez az energia felszabadul.
- Hidrogén: A hidrogén, mint energiahordozó, a kémiai belső energiáját tárolja. Égése során vízzé alakul, miközben nagy mennyiségű energiát szabadít fel. A hidrogén előállítása (pl. elektrolízissel) energiát igényel, amelyet kémiai belső energia formájában tárol.
- Üzemanyagok: A fosszilis üzemanyagok (szén, olaj, földgáz) és a bioüzemanyagok (etanol, biodízel) mind a bennük lévő kémiai belső energiát hasznosítják égés során.
- Potenciális energia tárolás: Bár nem közvetlenül belső energia, a potenciális energia tárolása is kapcsolódik az energiaegyensúlyhoz. Például a szivattyús-tárolós vízerőművek éjszaka, amikor olcsó az áram, vizet pumpálnak egy magasabban fekvő tározóba, növelve annak helyzeti energiáját. Nappal, amikor drágább az áram, a vizet leengedik, és turbinákat hajtva elektromos energiát termelnek. A rendszer teljes energiája a helyzeti energia és a víz belső energiájának összege.
Az energiatárolási megoldások fejlesztése során a mérnököknek és tudósoknak folyamatosan optimalizálniuk kell az anyagok belső energia-tároló képességét, az energiaátalakítás hatékonyságát és a rendszerek biztonságát. A belső energia alapos megértése nélkülözhetetlen ezen a dinamikusan fejlődő területen.